Mineralsäuren
Der Begriff Mineralsäuren umfasst im weitesten Sinn alle Säuren, die anorganischer Natur sind (also, abgesehen von der Kohlensäure, keinen Kohlenstoff enthalten).
Im engeren Sinne meint man damit aber die drei wichtigen starken Säuren Salzsäure HCl, Salpetersäure HNO3 und Schwefelsäure H2SO4. Diese Säuren werden wir in diesem Kapitel im Detail und in verschiedenen Anwendungsgebieten betrachten. Du musst für den MedAT nicht alle gelisteten Anwendungsbeispiele auswendig können. Sie dienen vielmehr dazu, dir greifbare Beispiele dafür zu geben, welche Rolle die Säure-Base-Chemie in unserem Leben spielt.
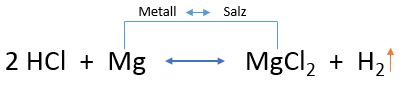
Salzsäure ist eine einwertige Säure, sie hat nur ein H+-Ion zu vergeben, dieses gibt sie aber sehr bereitwillig ab. HCl zählt mit einem pKS von etwa -6.0 eindeutig zu den starken Säuren, was sich in den folgenden Praxisbeispielen gut erkennen lässt:
- Biologische Bedeutung: Bestandteil der Magensäure und zuständig für die Denaturierung (u.a. Lösen der Wasserstoffbrückenbindungen) der Proteine sowie als Bakterientöter. Im sauren Milieu stellt sie gute Gegebenheiten für das Verdauungsenzym Pepsin her.
- Eigenschaften: farblose, rauchende, starke Säure (Flüssigkeit), die nahezu vollständig dissoziiert: HCl + H2O ⇔Cl- + H3O+
- Bei Erhitzen: Bildung von Chlorwasserstoff (HCl(g)), der sich als stark stechender Geruch äußert.
Die Salzsäure hat ein relativ hohes Oxidationspotential und vermag unedle Metalle (siehe elektrochemische Spannungsreihe) zu oxidieren. Diese Fähigkeit macht man sich sowohl in der chemischen Analytik als auch in der Industrie zunutze. Die nachfolgende Abbildung zeigt die Oxidation unedler Metalle (Magnesium und Zink), wobei Chloride als Salze und flüchtiger Wasserstoff (entzündlich! daher industriell unter Schutzgas) entstehen. Kupfer, ein edles Metall, kann dieser Oxidation widerstehen.

Oxidation in 10%iger HCl (Quelle:https://www.seilnacht.com/Chemie/ch_hcl.htm)
Beispiel:
Einsatzgebiete der Salzsäure:
- Analytik (Laborversuche und qualitative Elementanalytik)
- Herstellung von Chloriden
- Kunststoffindustrie (PVC, ...)
- Grundchemikalie in der Industrie
- Erzaufbereitung ("saurer Aufschluss")
- Metallographie (Ätzen von Metallen)
- Reinigungsindustrie (Fliesenentkalker, ...)
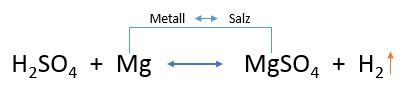
Schwefelsäure ist eine mehrprotonige Säure, das heißt ihr Salz HSO4- kann wiederum ein Proton abgeben. Auch die Schwefelsäure zählt zu den starken Säuren (pKS (H2SO4) = -3.0).
- Biologische Bedeutung: Schwefelige Säure (H2SO3) und Schwefelsäure (H2SO4) sind Bestandteile des sauren Regens. Als sauren Regen bezeichnet man durch Stickstoffoxide, Schwefeldioxide, Stickstoffmonoxide und weitere saure Substanzen belasteten Niederschlag. Dieser hat drastische Folgen für die Umwelt, besonders für den Nährstoffhaushalt des Bodens. Durch den niedrigen pH-Wert des Regenwassers (pH < 5, leicht saures Milieu) ändert sich die Löslichkeit einiger lebensnotwendiger und auch lebensfeindlicher Metallionen im Boden: Die Aufnahmefähigkeit des Bodens für Magnesium (Mg2+), Kalium (K+), Natrium (Na+) und andere wichtige Metallkationen sinkt (= Auswaschung des Bodens), wobei sich auf der anderen Seite die Löslichkeit für das für den Boden giftige Aluminium erhöht. Industrielle (Teil-)Maßnahmen gegen die Bildung des sauren Regens sind die Rauchgasentschwefelung sowie die Einführung von schwefeldioxidarmen Kraftstoffen im Transportwesen. (Quelle: https://www.ag-umwelt.net/saurer-regen/)
- Eigenschaften: Schwefelsäure ist eine farblose, ölige Flüssigkeit, die stark hygroskopisch (feuchtigkeitsbindend) ist und mit Wasser exotherm reagiert (plötzliches Sieden möglich); Schwefelsäure zersetzt leicht organische Stoffe (Zucker, Baumwolle, ...) unter Bildung von pechschwarzem Kohlenstoff.
- Auch die Schwefelsäure hat ausreichendes Oxidationspotential, um unedle Metalle in Salze umzuwandeln. Dabei bildet es sulfathaltige Salze aus. Die nachfolgende Reaktion stellt eine Metalloxidation des Magnesiums dar.

Oxidation in 10%iger H2SO4 (Quelle:https://www.seilnacht.com/Chemie/ch_hcl.htm)
Beispiel:
Einsatzgebiete der Schwefelsäure:
- Analytik (Laborversuche und qualitative Elementanalytik)
- Düngemittelherstellung
- Herstellung von Sulfaten
- Grundchemikalie in der Industrie
- Erzaufbereitung ("saurer Aufschluss"; Titanmineralien)
- Sprengstoffherstellung (Nitriersäure mit HNO3)
- Trocknungsmittel (da hygroskopisch)
- Katalysator bei vielen organischen Reaktionen (Wasserentzug)
- "Autobatterie" (Batteriesäure im Bleiakkumulator)
Wahrscheinlich ahnst du es schon: Auch diese Säure ist sehr dissoziationsfreudig (pKS = -1.3), jedoch nicht ganz so ätzend wie die bisher besprochenen Säuren.
- Biologische Bedeutung: Nitrate, die Salze der Salpetersäure, werden von Pflanzen als Nährstoffe verwertet und in der Landwirtschaft als Düngemittel eingesetzt. Sie können direkt von pflanzlichen Organismen als Stickstoffquelle aufgenommen und verwertet werden. Sie werden in einem Kreislauf, der sogenannten Stickstofffixierung (siehe Kapitel "Elemente und deren Verbindungen - Stickstoff") gebildet und der Umwelt zur Verfügung gestellt oder aber, wie zuvor erwähnt, über die Düngung bereitgestellt.
- Eigenschaften: farblose bis gelbliche, rauchende Flüssigkeit (wegen der Bildung von NO2), starkes Oxidationsmittel, welches Holz und andere Naturstoffe spontan entzünden kann.
Im Gegensatz zur Salz- und Schwefelsäure besitzt Salpetersäure das nötige Potential, um selbst einige edle Metalle wie Kupfer und Silber aufzulösen. Beständigeren Edelmetallen wie Gold und Platin kann die Säure aber nichts anhaben. Erst mit einer Mischung von konzentrierter HCl sowie konzentrierter HNO3 (3:1), dem sogenannten Königswasser, lassen sich auch die letztgenannten Elemente auflösen (Abbildung rechte Eprouvette).
Die nachfolgende Abbildung zeigt die Auflösung einiger Metalle, wobei als Reaktionsprodukt ein Salz (Nitrat) entsteht.

Oxidation in konzentrierter HNO3 (Quelle:https://www.seilnacht.com/Chemie/ch_hcl.htm)
Beispiel:
.JPG)
Einsatzgebiete der Salpetersäure:
- Analytik (Laborversuche und qualitative Elementanalytik)
- Düngemittelherstellung
- Grundchemikalie in der Industrie
- Herstellung von Nitraten
- Herstellung von Explosivstoffen (TNT = Trinitrotoluol; Nitroglycerin)
- Nitrierung von chemischen Verbindungen
- als Kaliumnitrat im Schwarzpulver


Durch die Gefahrensymbole wird darauf hingewiesen, dass diese Säuren stark ätzend sind.
Ursprünglich wurden alle Säuren, deren Salze in Mineralien vorkommen, als Mineralsäuren bezeichnet, also auch die Kohlensäure und der Schwefelwasserstoff. In manchen Lehrbüchern wird die Phosphorsäure (H3PO4) auch zu den Mineralsäuren gezählt.